Tính chất của axit và cách xác định độ mạnh yếu của Axit sẽ có ngay trong bài viết này của chúng tôi. Hãy theo dõi bài viết này để không bỏ lỡ những nội dung hấp dẫn và có ích nhất nhé !
Tham khảo bài viết khác:
Tính Chất Vật Lý Của AXIT
Tóm tắt nội dung
- 1 Tính Chất Vật Lý Của AXIT
- 2 Tính Chất Hóa Học Của AXIT
- 2.1 1. Làm đổi màu chất chỉ thị (quỳ tím, giấy chỉ thị pH, dung dịch phenol phtalein).
- 2.2 2. Tác dụng được với một số kim loại tạo thành muối và giải phóng hidro.
- 2.3 3. Tác dụng với bazo tạo thành muối và nước
- 2.4 4. Tác dụng với oxit bazơ tạo thành muối + nước
- 2.5 5. Tác dụng với muối tạo muối mới và axit mới
- 3 Xác định độ mạnh yếu của axit
- Tính chất vật lý của axit
- Tan trong nước, có vị chua.
- Khi tiếp xúc với axit mạnh, có cảm giác đau nhói.
- Là chất điện li nên có thể dẫn điện.
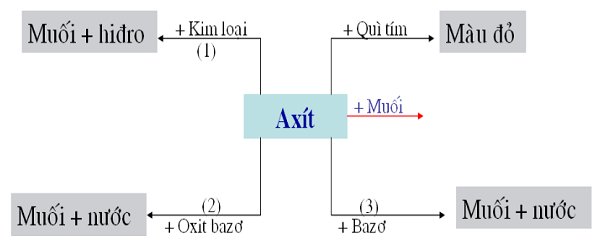
Tính Chất Hóa Học Của AXIT
1. Làm đổi màu chất chỉ thị (quỳ tím, giấy chỉ thị pH, dung dịch phenol phtalein).

2. Tác dụng được với một số kim loại tạo thành muối và giải phóng hidro.
Đối với axit sulfuric và axit nitric đặc nóng có thể tác dụng với hầu hết các kim loại, tạo khí lưu huỳnh dioxit SO2 (H2SO4) hoặc nito dioxit NO2 (HNO3)
HCl + Fe -> FeCl2 + H2
2Fe + 6H2SO4 -> Fe2(SO4)3 + 6H2O + 3SO2
3. Tác dụng với bazo tạo thành muối và nước
Cu(OH)2 + H2SO4 -> CuSO4 + 2H2O
4. Tác dụng với oxit bazơ tạo thành muối + nước
Na2O + 2HCl → 2NaCl + H2
FeO + H2SO4(loãng) → FeSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
5. Tác dụng với muối tạo muối mới và axit mới
Điều kiện xảy ra phản ứng
- Muối phản ứng là muối tan.
- Muối mới không tan trong axit mới.
- Sản phẩm có chứa một chất kết tủa hoặc bay hơi.
H2SO4 + BaCl2 → BaSO4(r) + 2HCl
K2CO3 + 2HCl → 2KCl + H2O + CO2 (axit cacbonic phân hủy ra nước và khí cacbonic)
Xác định độ mạnh yếu của axit
==> Độ mạnh, yếu của các axit được xác định dựa vào sự linh động của nguyên tử Hydro trong axit đó, nếu nguyên tử Hydro càng linh động thì tính axit càng mạnh và ngược lại.
1. Với những axit có oxy trong cùng một nguyên tố, càng ít oxy, axit càng yếu
HClO4 > HClO3> HClO2> HClO
2. Với những axit của nguyên tố trong cùng chu kỳ, khi các nguyên tố ở hóa trị cao nhất, nguyên tố trung tâm có tính phi kim càng yếu thì axit đó càng yếu.
HClO4> H2SO4> H3PO4
3. Với axit của nguyên tố cùng nhóm A
+) Axit có oxy: Tính axit tăng dần từ dưới lên: HIO4 < HbrO4< HClO4
+) Axit không có oxy: Tính axit giảm dần từ dưới lên: HI > HBr> HCl> HF
4. Với axit hữu cơ RCOOH
Nếu R đẩy electron (gốc R no) thì tính axit giảm
HCOOH> CH3COOH> CH3CH2COOH> CH3CH2CH2COOH> n-C4H9COOH.
Nếu R hút e (gốc R không no, thơm hoặc có nguyên tố halogen,…), tính axit sẽ mạnh
Cám ơn bạn đã theo dõi bài viết này của chúng tôi, cùng theo dõi những bài viết khác trên trang web của chúng tôi để không bỏ lỡ những thông tin hay và hữu ích khác nhé !